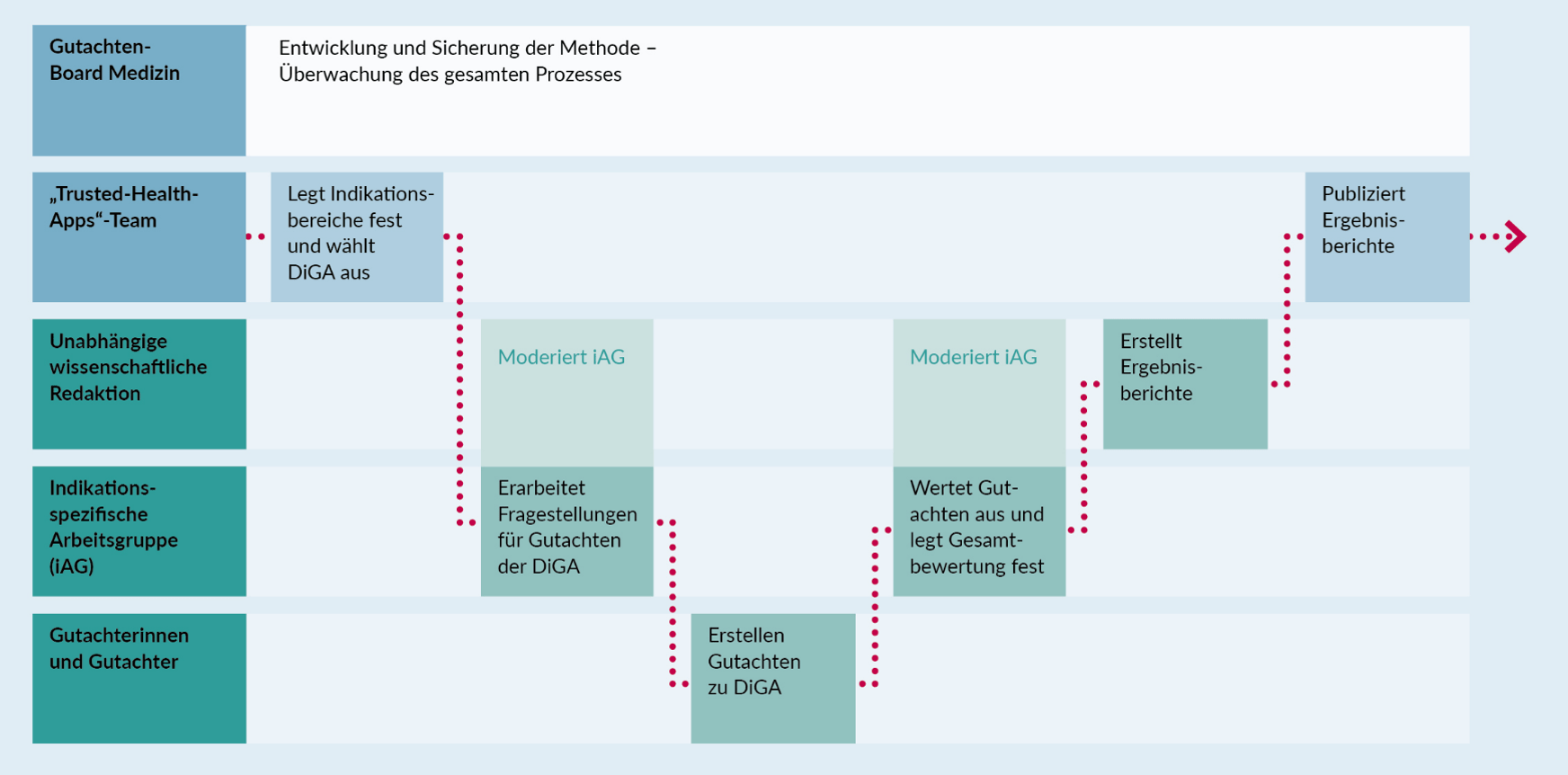
Digitale Gesundheitsanwendungen als Technologie haben ein großes Potenzial für eine niedrigschwellige, am Patientenwohl orientierte Versorgung. Nutzerinnen und Nutzer erlangen mehr Souveränität im Umgang mit der eigenen Gesundheit. Zudem können DiGA Unterstützung bei der Überwindung von Hürden im Gesundheitssystem leisten – etwa bei der Überbrückung langer Wartezeiten bis zum nächsten Behandlungstermin. Wie die nun abgeschlossene Pilotphase unseres Projekts „Trusted Health Apps“ gezeigt hat, sind zwei Faktoren Voraussetzung dafür, ob der Einsatz von DiGA letztlich nutzenstiftend ist. Zum einen: Gibt es detaillierte Informationen über die medizinische Qualität von DiGA, die es erlauben, verschiedene Anwendungen miteinander zu vergleichen? Und zum anderen: Finden diese Informationen ihren Weg zu Ärztinnen und Psychotherapeuten, damit sie DiGA gezielt in die Behandlung von Patientinnen und Patienten integrieren können?
Unter dem Titel „Trusted Health Apps“ arbeiten die Bertelsmann Stiftung und ihre Tochter Weisse Liste seit 2019 daran, Lösungen für mehr Transparenz im Bereich der DiGA[1] zu entwickeln. Dabei ist die medizinische Qualität ein zentraler Paramater für die Auswahl und Nutzung einer DiGA – sowohl durch Patienten als auch durch Gesundheitsfachkräfte. Verschiedene Analysen zeigen zudem, dass DiGA vor allem dann genutzt werden, wenn sie von Behandelnden empfohlen werden. Grundlage für die Arbeit im Projekt ist daher die Annahme, dass das Vertrauen der Gesundheitsfachkräfte in die Qualität von DiGA entscheidend für deren umfassende Etablierung im Versorgungsalltag ist.
Ein Zwischenresümee nach Abschluss der Pilotphase
Gemeinsam mit unserem Expertengremium aus Medizinerinnen und Psychotherapeuten haben wir daher im vergangenen Jahr ein Verfahren zur Begutachtung von DiGA aus medizinischer Perspektive entwickelt und pilotiert. Unter Einbeziehung unabhängiger Fachleute wurden dabei die medizinisch-fachliche Fundierung sowie die Qualität der Evidenz von sieben DiGA aus drei Indikationsbereichen bewertet. Aus dieser Erprobung ist neben einer Methodendokumentation ein „Lessons-Learned“-Papier hervorgegangen, in dem wir erste Schlussfolgerungen für eine gute Praxis bei der DiGA-Entwicklung formulieren. In einem nächsten Schritt möchten wir diese im Rahmen eines Stakeholder-Dialogs zur Diskussion stellen.
Fünf „Lessons Learned“
Die im Folgenden aufgeführten fünf „Lessons Learned“ stellen einen Auszug aus dem kürzlich veröffentlichten Paper dar. Dabei wird zunächst das Problem beschrieben – danach werden Lösungsvorschläge an verschiedene Stakeholder adressiert:
1) Umfassend informieren
Derzeit fehlen sowohl Ärzten als auch Patienten Möglichkeiten, aussagekräftige und verlässliche Informationen über die medizinische Qualität von DiGA zu erhalten.
BfArM: Herstellung von umfassender Transparenz über die medizinische Qualität von DiGA, einschließlich der Einordnung der Evidenzgraduierung im Sinne einer Fachinformationspflicht. Diese Informationen müssen für alle als Medizinprodukt zugelassenen digitalen Gesundheitsanwendungen über eine zentrale und frei zugängliche Online-Plattform verfügbar sein.
2) Geeignete Studiendesigns einsetzen
Die Qualität der Evidenz der positiven Versorgungseffekte erfüllt nicht immer die notwendigen wissenschaftlichen Qualitätsanforderungen. Selbst wenn entsprechende Studien vorgelegt werden, sind diese in ihrer Aussagekraft häufig unzureichend. Zentrale Probleme stellen hierbei die Ein- / Ausschlusskriterien, der Selektionsbias, die Fallzahl, die Vergleichsgruppe, die Auswahl relevanter Endpunkte, die Drop-out-Rate und / oder die Evidenzgüte der Studie dar.
Hersteller: Aussagekräftige und qualitativ hochwertige Forschung zu Wirkweise und Nutzen der DiGA sollte als Kernprozess in deren Entwicklung und Markteinführung integriert sein.
Branchenverbände: Die Verbände der (Gesundheits-) IT-Branche sollten kleinere Unternehmen bei der Konzeption und gegebenenfalls auch bei der Durchführung solcher Studien unterstützten.
Fachgesellschaften: Beratungsangebote der indikationsspezifisch jeweils betroffenen Fachgesellschaft(en) sollten den Herstellern niedrigschwellig offenstehen.
3) DiGA in Behandlungsmethode einbetten
DiGA bewegen sich im Graubereich zwischen Medizinprodukt und medizinisch therapeutischer Dienstleistung. Mit Blick auf ihren Nutzen lassen sich viele Anwendungen nicht von ihrem jeweiligen ärztlichen und / oder (psycho)therapeutischen Versorgungskontext isoliert betrachten – auch wenn dies derzeit noch die vorherrschende Meinung ist. Gerade bei DiGA mit indirekten (z. B. Chroniker-Tagebücher, Monitoring) und direkten Interventionen (z. B. Therapieprogramme basierend auf Prinzipien der kognitiven Verhaltenstherapie) kann die Begleitung durch Fachpersonal für die Patientensicherheit entscheidend sein.
Hersteller: Anwendungen sollten als Teil eines integrierten Versorgungsprozesses möglichst in Kooperation mit klinisch tätigen Partnern entwickelt und eingesetzt werden (hybride Versorgungsmodelle).
Regulatoren / Kostenträger: Die Prüfsystematik für die Erstattungsfähigkeit sollte auch auf hybride Lösungen (z. B. Blended-Therapie, Stepped Care) zugeschnitten werden und diese im Bewertungsverfahren integrieren. Die Erstattung müsste dann auch die medizinische Dienstleistung einschließen – was wiederum in der Kosten-Nutzen-Abwägung zu berücksichtigen wäre. Das würde den Rahmen des bisherigen BfArM-Fast-Track-Verfahrens sprengen. Dass der Gemeinsame Bundesausschuss (G-BA) auf Empfehlung des Innovationsausschusses derzeit prüft, eine weitere Option für die kollektive Erstattung von DiGA zu eröffnen, ist daher zu begrüßen.
Fachgesellschaften: Evidenzbasierte Anwendungen und zugehörige Versorgungsprozesse sollten zeitnah in Leitlinien der Arbeitsgemeinschaft der wissenschaftlichen medizinischen Fachgesellschaften (AWMF) abgebildet werden. Dieser Prozess kann durch das Ärztliche Zentrum für Qualität in der Medizin (ÄZQ) unterstützt werden.
Versorgungsforschung: Phase-IV-Studien, also klinische Studien nach der Zulassung, sollten zur weiteren Risiko-Nutzen-Abschätzung an einem größeren Patientenkollektiv und / oder an speziellen Patientengruppen durchgeführt werden. Hierbei könnte die Evaluation von „Real World Data“ (RWD) eine Beurteilung unter näherem Praxisbezug erlauben.
4) Technisches und medizinisches Wissen zusammenführen
Die meisten DiGA-Hersteller sind an einem fachlichen Austausch mit Expertinnen und Experten der Medizin- und / oder Gesundheitswissenschaft im Sinne eines kontinuierlichen gemeinsamen Lernprozesses für mehr Qualität durchaus interessiert. Allerdings fehlen derzeit noch die entsprechenden neutralen Foren für einen solchen Austausch.
Fachgesellschaften: Die medizinischen und (psycho)therapeutischen Fachgesellschaften sollten einen strukturierten Austausch mit Herstellern im Sinne gemeinsamer „Arbeitsgruppen“ anbieten und organisieren. Dabei sollten Leitlinien zeitnah an den sich agil entwickelnden Stand der publizierten Evidenz angepasst werden.
5) Unabhängigkeit der Forschung stärken
Da in Deutschland die medizin-wissenschaftliche Forschung im Feld der digitalen Gesundheitsanwendungen sich gerade erst zu etablieren beginnt, ist eine industrieunabhängige Expertise derzeit noch schwer zu finden.
Wissenschaft: Der in der Scientific Community international bereits gut etablierte Standard, eigene Interessenkonflikte offenzulegen, muss gerade in diesem neuen Forschungsfeld streng beachtet werden.
Forschungspolitik: Ein Förderprogramm zum Nutzennachweis von Digital Health bzw. DiGA kann Anreize zum Aufbau von spezialisierten Forschungsstandorten in Deutschland setzen. Dies betrifft in besonderem Maße die Integration in einen (intersektoralen) Gesamtbehandlungsablauf (z. B. bei Monitoring, indirekten und direkten Interventionen).
[1] Gemeint sind sowohl DiGA im Sinne von §§ 33a und 139e SGB V als auch weitere Gesundheits-Apps mit Zulassung als Medizinprodukt nach § 3 Medizinproduktegesetz (MPG).