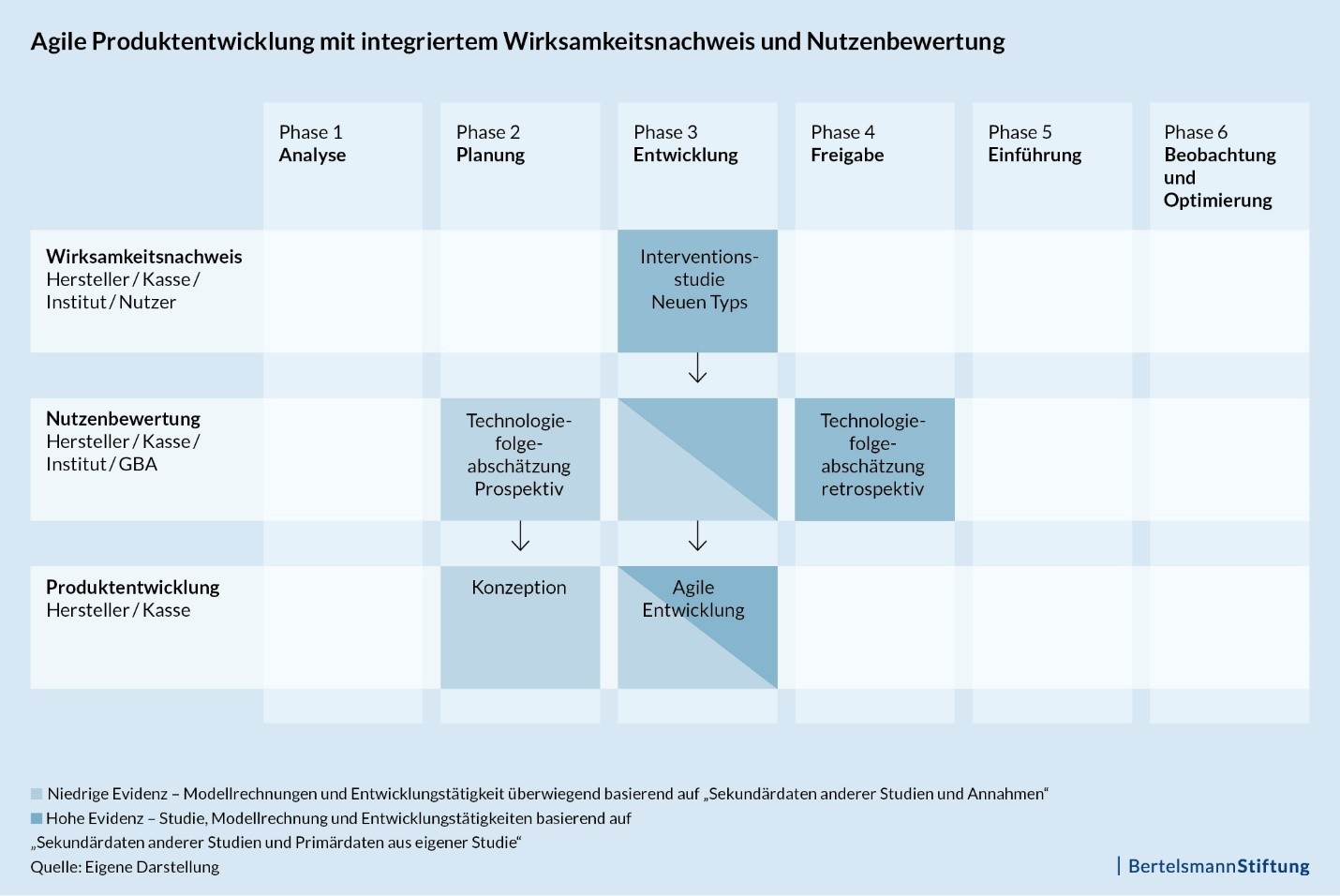
Das Projekt „Der digitale Patient“ beschäftigt sich damit, wie nutzenstiftende Gesundheits-Apps und Webanwendungen für Bürger schneller in die Regelversorgung überführt werden können. In einzelnen Teilberichten zum „Transfer von Digital-Health-Anwendungen in den Versorgungsalltag“ widmen wir uns verschiedenen Markzugangshürden und erarbeiten Vorschläge zur Verbesserung der Rahmenbedingungen. Der aktuelle Teilbericht zeigt, dass die klassischen Methoden des Wirksamkeitsnachweises und der Nutzenbewertung für agil entwickelte Digital-Health-Anwendungen zu schwerfällig sind. Abgeleitet aus der Analyse schlagen wir unter anderem agile, entwicklungsbegleitende Interventionsstudien sowie eine prospektive Technologiefolgeabschätzung von Digital-Health-Anwendungen vor. Der Digital-Health-Experte Karsten Knöppler, der den Teilbericht mit seinem Team im Auftrag der Bertelsmann Stiftung verfasst hat, erklärt im Interview, warum es einen neuen Methodenstandard braucht.
Herr Knöppler, welchen Herausforderungen stehen Anbieter von Digital-Health-Anwendungen gegenüber, wenn es um den Wirksamkeitsnachweis und die Nutzenbewertung geht?
 Knöppler: „Der Markt für Digital Health zeichnet sich aus durch schnelle Innovationszyklen, einen Fokus auf Angebote für den zweiten Gesundheitsmarkt und ein niedriges Preisniveau. Noch weitgehend ungenutzt sind die Potenziale im Marktsegment der Kranken – dem sogenannten ersten Gesundheitsmarkt. Und hier steigen die regulatorischen Anforderungen erheblich und es entsteht ein höherer Aufwand. Gleichzeitig werden kleinere Zielgruppen angesprochen; das verschlechtert das Absatzpotenzial und die Refinanzierung der Aufwände. Darum müssen sich alle Akteure auf ein höheres Preisniveau einstellen, wenn sie die Potenziale von Digital Health im Versorgungsalltag, also im ersten Gesundheitsmarkt nutzen wollen.
Knöppler: „Der Markt für Digital Health zeichnet sich aus durch schnelle Innovationszyklen, einen Fokus auf Angebote für den zweiten Gesundheitsmarkt und ein niedriges Preisniveau. Noch weitgehend ungenutzt sind die Potenziale im Marktsegment der Kranken – dem sogenannten ersten Gesundheitsmarkt. Und hier steigen die regulatorischen Anforderungen erheblich und es entsteht ein höherer Aufwand. Gleichzeitig werden kleinere Zielgruppen angesprochen; das verschlechtert das Absatzpotenzial und die Refinanzierung der Aufwände. Darum müssen sich alle Akteure auf ein höheres Preisniveau einstellen, wenn sie die Potenziale von Digital Health im Versorgungsalltag, also im ersten Gesundheitsmarkt nutzen wollen.
Genau das stellt jedoch die Hersteller unter den Erwartungsdruck, als ‚Herausforderer‘ bestehender Therapieoptionen zu agieren. Gerade Digital-Health-Anwendungen müssen daher besonders wirksam sein, müssen trotz der kurzen Entwicklungszyklen die Wirksamkeit mit marktüblich hoher Evidenz nachweisen können und den Nutzen im Vergleich zu anderen Optionen auch gesundheitsökonomisch belegen.
Die heute etablierten, klassischen Verfahren hierfür – die randomisierten kontrollierten Studien (RCT) und die Technologiefolgeabschätzung (HTA) – sind in der klassischen Anwendungsform mit den schnellen Innovationszyklen aber nicht vereinbar, unter anderem weil sie erst nach der eigentlichen Produktentwicklung erfolgen, sehr aufwändig sind und nicht auf digitale Teilprodukte aus der agilen, interaktiven Entwicklung anwendbar sind. Zudem haben Digital-Health-Anbieter in der Regel eine geringe methodische Kompetenz in diesem Fachbereich und die in Deutschland etablierten Forschungseinrichtungen haben ihren Arbeits- und Kompetenzschwerpunkt überwiegend im Bereich klassischer Methoden.“
Im gerade veröffentlichten Teilbericht schlagen Sie den Einsatz neuer agiler Methoden für Wirksamkeitsnachweis und Nutzenbewertung vor. Was zeichnet Ihren Ansatz und diese Methode aus?
Knöppler: „Die neuen Methoden können schon vor und während der Produktentwicklung angewendet werden und geben den Entwicklern in diesem Prozess wesentliche Hinweise für die Produktoptimierung. Die Wirksamkeit und der gesundheitsökonomische Nutzen sind – vereinfacht gesprochen – dann bereits mit der Fertigstellung der Produktentwicklung oder eines Releases quantifizierbar. Die Produkte sind durch das interaktive Feedback aus der Begleitforschung wirksamer, daher sinkt das Risiko für Investoren. Und für die Verhandlung mit Kostenträgern liegt eine fundierte gesundheitsökonomische Faktenbasis vor, die dann auch ein höheres Preisniveau rechtfertigt.“
Wo sehen Sie weiteren Handlungsbedarf, um den Einsatz und die Akzeptanz neuer Studiendesigns und neuer Methoden zu fördern?
Knöppler: „Wesentlich ist aus meiner Sicht ein Paradigmenwechsel. Studien zum Wirksamkeitsnachweis und HTAs sollten nicht als notwendiges Übel im Kontext der Vergütungsverfahren gesehen werden, sondern als Grundvoraussetzung, um in schnellen Märkten ein überzeugendes Produkt zu entwickeln. Dafür müssen Hersteller insbesondere die sogenannte prospektive Technologiefolgeabschätzung als ersten Schritt der Produktentwicklung sehen und die erforderlichen Aufwände und Ressourcen bereits in Businessplan und Finanzierungsrunden einplanen.
Außerdem bedarf es bei Herstellen und Forschungseinrichtungen sowohl einer spezifischen Methodenkompetenz als auch einer agilen, integrierten Zusammenarbeit zwischen Forschern und Produktentwicklungsteam. Eine gezielte produktbezogene Forschungsförderung für genau diese Methodik und Arbeitsweise wäre aus meiner Sicht ein erfolgversprechendes politisches Mittel, um den Standort Deutschland im Bereich Digital Health wettbewerbsfähig zu machen – genauso wettbewerbsfähig, wie wir es aus dem Bereich der Medizinprodukte gewohnt sind. Das sind wir heute im internationalen Vergleich nämlich noch nicht.“
Worauf sollten Anbieter und Forscher achten, wenn es um den Wirkungsnachweis von Digital Health geht?
Knöppler: „Wichtig ist es, die Studiendesigns so auszugestalten, dass sie einerseits das Evidenzniveau eines klassischen RCT erreichen und andererseits eine Bewertung einzelner Module einer Digital-Health-Anwendung vornehmen. Diese müssen auch die Interaktion und die verschiedenen Kombinationsvarianten von Modulen in der digitalen Anwendung betrachten. Wichtig ist das Grundverständnis, dass die Anforderungen an Studien im Kontext der Medizinproduktezertifizierung deutlich niedriger sind als im Kontext der Vergütung durch die gesetzliche Krankenversicherung. Zudem hängen die Anforderungen auch von der Vergütungsart und dem Typ der Digital-Health-Anwendung ab. Ausreichende Stichprobengrößen, Randomisierung und Kontrollgruppen sind dabei natürlich Grundvoraussetzungen für die Evidenz und Akzeptanz bei Krankenkassen, Selbstverwaltungsorganen und Wissenschaftscommunity.“
Karsten Knöppler, Diplom-Betriebswirt, ist Geschäftsführer der fbeta GmbH, Experte und Berater für die Themen „Gesundheits- und Versorgungsmanagement“ sowie „Gesundheits-IT“. Zuvor war er u.a. im AOK-Bundesverband, der gevko in der AOK Systems und im IGES Institut mit den Schwerpunkten „Krankenkassen“ und „Neue Versorgungsformen“ tätig. Zudem hat er im Kontext der Disease-Management-Programme in der Versorgungsforschung, Entwicklung und Einführung u.a. bei ANYCARE gearbeitet.
Abonnieren Sie hier unseren Newsletter: